
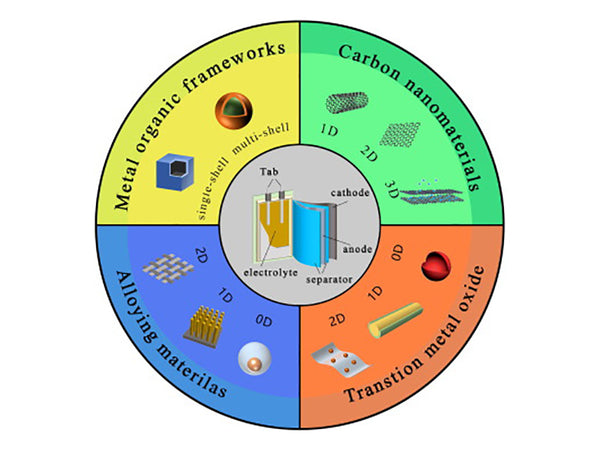
主要内容:
锂离子电池的负极材料主要作为储锂主体,实现锂离子在充放电过程中的嵌入和脱嵌。从锂离子电池的发展来看,正极材料的研究对锂离子电池的出现起到了决定性的作用。正是因为碳材料的出现,解决了金属锂电极的安全问题,直接带动了锂离子电池的应用。工业化锂离子电池的负极材料主要是各种碳材料,包括石墨化碳材料和非晶碳材料,如天然石墨、改性石墨、石墨化中间相碳珠、和软碳(如焦炭)和一些硬炭等。其他非碳负极材料包括氮化物、硅基材料、锡基材料、钛基材料、合金材料等。纳米级材料由于其独特的性能也被广泛关注于正极材料的研究;而正极材料的薄膜化是近年来化学电源尤其是锂二次电池对高性能负极和微电子工业发展的要求。
锂离子二次电池负极材料的开发经历了一个漫长的过程。最早研究的负极材料是金属锂。由于电池安全问题和循环性能差,金属锂一直没有用于锂二次电池。锂合金的出现在一定程度上解决了金属锂负极的安全隐患,但锂合金在反复循环过程中体积发生较大变化,电极材料会逐渐粉化,电池容量会迅速衰减,这使得锂合金尚未成功用作锂二次电池的负极材料。碳材料在锂二次电池中的成功应用促进了锂离子电池的生产,从那时起,人们对多种碳材料进行了研究。但碳材料存在比容量低、首次充放电效率低、有机溶剂共嵌入等问题。因此,人们在研究碳材料的同时,也开始开发其他高比容量的非碳负极材料,如锡基负极。材料、硅基负极材料、氮化物、钛基负极材料、合金新材料。
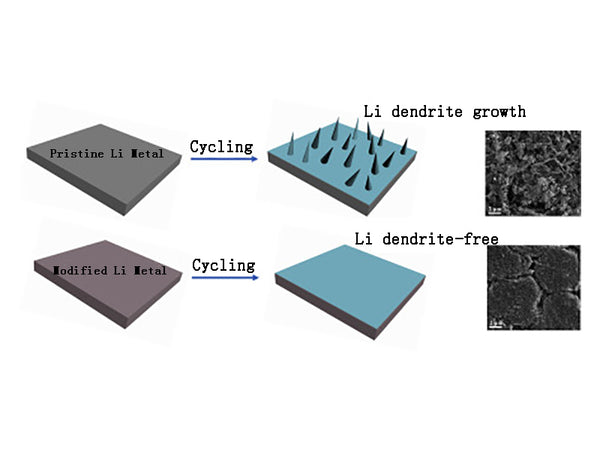
金属锂及其合金
1.金属锂及其合金
最早研究的锂二次电池负极材料是金属锂,因为锂具有最大的负极电位(-3.045V)和最高的质量比容量(3860mA·h/g)。但是,当使用锂作为负极时,金属锂在充电过程中并没有均匀地沉积在电极表面,导致锂在某些部位沉积过快,从而产生树枝状晶体(dendrites)。当枝晶发展到一定程度时,一方面会断裂,产生“死锂”,造成不可逆锂;另一方面,枝晶刺穿隔膜,导致内部短路和电池爆炸。此外,锂具有很大的反应活性,可能与电解液发生反应,并且还可能消耗活性锂,造成安全问题。正是由于锂枝晶和锂与电解液反应可能引起的诸多问题,以锂为负极的二次锂电池一直没有商业化。目前主要在三个方面开展工作:①寻找金属锂的替代正极材料;②采用聚合物或熔盐电解质,避免金属锂与有机溶剂发生反应;③寻找合适的电解质配方,使金属锂在沉积和溶解过程中保持光滑均匀的表面。以锂为负极的二次锂电池尚未商业化。目前主要在三个方面开展工作:①寻找金属锂的替代正极材料;②采用聚合物或熔盐电解质,避免金属锂与有机溶剂发生反应;③寻找合适的电解质配方,使金属锂在沉积和溶解过程中保持光滑均匀的表面。以锂为负极的二次锂电池尚未商业化。目前主要在三个方面开展工作:①寻找金属锂的替代正极材料;②采用聚合物或熔盐电解质,避免金属锂与有机溶剂发生反应;③寻找合适的电解质配方,使金属锂在沉积和溶解过程中保持光滑均匀的表面。
历史上,对锂合金的系统研究始于高温熔盐体系。研究体系包括Li-Al、Li-Si、Li-Mg、Li-Sn、Li-Bi和Li-Sb。化学合金化反应的系统研究始于戴伊的工作。后来的研究表明,锂在室温下可以在电化学过程中与许多金属发生合金化反应。Huggins对各种二元和三元锂合金作为负极在有机溶剂体系中的行为,特别是锂锡体系、锂锑体系、锂铅体系的热力学和动力学行为进行了系统的研究。
与金属锂相比,锂合金负极避免了枝晶的生长,从而提高了安全性。但由于合金材料在反复循环过程中发生较大的体积变化,电极材料会逐渐粉化,电池容量会迅速衰减。
为了解决合金材料的粉化问题,不同的研究人员提出了不同的解决方案。Huggins提出将活性Li x Si合金均匀分散在非活性(所谓非活性是指在一定电位下不参与反应)Li x Sn或Li x Cd中,形成混合导体全固态复合体系。有人提出将锂合金分散在导电聚合物中形成复合材料;将小颗粒合金嵌入稳定的网络支撑中。这些措施在一定程度上抑制了合金材料的粉化,但仍不符合实用要求。
随着负极概念的突破,负极材料不再需要含有锂,这让合金材料的制备有了更多的选择。
无锂金属间化合物用于研究锂离子电池正极。有两种类型的金属间化合物。一种是两种嵌锂合金之间的金属间化合物,如SnSb、SnAg、AgSi、GaSb、AlSb和InSb。这类金属间化合物,因不同的金属处于不同的电位而与锂发生合金化反应。当一种金属与锂发生合金化反应时,另一种金属呈惰性,相当于活性合金分散在非活性合金网络中。与单一金属相比,材料的循环性能有很大提高。另一类金属间化合物是能嵌入锂的活泼和惰性金属的合金,如Sb 2 Ti、Sb 2 V、Sn 2Co、Sn 2 Mn、Al 2 Cu、Ge 2 Fe、CuSn、Cu 2 Sb、Cr 2 Sb。这类合金中只有一种金属是活泼的,另一种则起导电惰性网络的作用。与前两种活性金属相比,金属间化合物的循环能力有所提高,但这是以比容量为代价的。的。
此外,多相合金的引入也改善了材料的循环,如Sn/SnSb x、Sn/SnAg x、SnFe/SnFeC、SnMnC。
金属间化合物并没有完全解决材料粉化问题,人们开始关注小尺寸材料。Besenhard发现,亚微米或纳米材料在循环过程中的碎裂变小,随着颗粒的减少,材料的循环变得更好。这是由于纳米材料在充放电过程中的绝对体积变化很小,可以很好地抑制材料的粉化。然而,由于纳米材料具有较大的表面积和表面能,在电化学循环过程中存在严重的电化学团聚问题。有人对纳米锡青铜合金在锂离子电池中的容量损失和容量衰减进行了研究。
另一个值得关注的合金研究成果是富士胶片使用锡基复合氧化物(TCO)作为锂离子电池的负极。该玻璃态锡基复合氧化物负极具有良好的循环性能。
碳材料
2.碳材料
锂合金的研究并没有直接带动锂离子电池的生产,非锂合金在锂离子电池出现前后都有研究。真正推动锂离子电池出现的是碳材料在锂离子电池中的应用。
碳材料作为锂离子电池的研究始于1980年代,但在此之前就已经研究了碳材料的嵌锂行为。早在 20 世纪 50 年代中期,Herold 就合成了 Li-graphite 插层化合物(GIC,graphite intercalated compound)。1976 年,Besenhard 发现锂可以从非水溶液中以电化学方式嵌入到石墨中。但由于充放电过程中石墨结构的膨胀和宏观结构的解体,这一问题一直没有得到解决。20世纪80年代初,有人报道了将锂与浸入熔融锂中的碳结合的研究,发现LiC 6可用作电池负极,拉开了碳作为锂离子电池负极研究的序幕。1985年,日本索尼公司提出使用无序非石墨化碳作为电池的负极,从而发明了锂离子电池。之后,索尼又成功推出了以LiCoO 2为正极、聚法夫醇(PFA)热解碳(硬碳)为负极的锂离子电池,从而实现了锂离子电池的商品化。表1显示了不同碳材料的开发过程。
表1 不同碳材料的历史背景
| 年 | 历史背景 |
| 1976年 | 碱金属离子在有机供体溶剂中的电化学嵌入行为的发现 |
| 1981 | 以LiC 6为负极、NbSe 3为正极、DOL为溶剂的熔盐电池的出现 |
| 1983 | 一种以锂化石墨为负极、LiCl O 4 /PC为电解液的聚合物电池 |
| 1985 | 无序非石墨化碳负极材料介绍 |
| 1990 | 以硬碳为负极的商用电池-Li/Mn O 2电对 |
| 1990 | 以焦炭为负极,LiMn O 2为正极,电解液为LiAsF 6 /(EC+PC) |
| 1993 | 石墨化MCMB和非石墨化VGCF正极材料介绍 |
备注:DOL-dioxalane,二氧戊环;PC-碳酸亚丙酯,碳酸亚丙酯;EC-ethylene carbonate,碳酸亚乙酯;MCMB-mesocarbon microbeads,中间相碳微珠;VGCF-vapour grown carbon fibre,气相生长碳纤维。
类石墨碳材料的锂嵌入行为已经被深入研究并得到大家的认可。石墨中的碳原子为sp 2杂化并形成层状结构。这些层通过范德华力结合,层中的原子以共价键结合。D.Guerard 等人。在石墨片状结构层间化学嵌入锂,形成一系列插层化合物,如LiC 24、LiC 18、LiCl 2、LiC 6等. JRDahn还证明了锂-石墨插层化合物是通过电化学方法形成的,在嵌锂过程中会形成一系列的插层化合物。由于石墨片之间范德华力较弱,在电化学插层反应过程中,部分溶剂化的锂离子也会将溶剂分子带入插层过程,导致溶剂共插,逐渐剥离石墨片状结构。. 这在以PC为溶剂的电解液体系中尤为明显。这也是索尼申请的第一代锂离子电池没有使用石墨而是使用非晶结构焦炭的原因。之后,
除石墨外,另一大类碳材料是无定形碳材料。所谓非晶态是指材料中缺乏完整的晶格结构。类似于玻璃结构中原子的排列,只有短序没有长序。非晶碳材料介于石墨和金刚石之间,碳原子有sp 2和sp 3杂化。

氧化物负极材料
3.氧化物负极材料
这里所说的氧化物不包括锡、铅等能与金属锂形成合金的金属氧化物。
氧化物负极材料要从80年代的高温电池说起。α-Fe 2 O 3和Fe 3 O 4高温电池(420℃)的放电平台为0.8~1.1V,容量可达700mA·h/g。电池性能的逐渐恶化可能是由于氧化锂逐渐扩散到电解液中引起的。. X射线衍射结果表明,α-Fe 2 O 3在放电过程中不可逆地从刚玉结构转变为尖晶石Fe 3 O 4结构,最终形成γ-Fe 2 O 3。在氧化过程中,γ-Fe 2O 3最后通过Fe 3 O 4形成中间相。然后在 1985 年 B.Scrosati 等人。报道了氧化铁在锂有机溶剂可充电电池中的电化学行为。同时,P.Novak 报道了氧化铜在锂电池中的电化学行为。1993年,Idota发现基于钒氧化物的材料可以在较低电位下每分子插入7个锂原子,容量为800-900 mA·h/g,循环性能良好。这重新燃起了人们对含氧材料在锂离子电池中应用的兴趣。JMTarascon 等人。研究了钒酸盐的可逆反应机理,认为该材料在第一次放电过程中形成了纳米金属颗粒与氧化锂的复合材料。在纳米金属颗粒的催化下,氧化锂中的锂氧键可逆地断裂。而形成是材料可逆能力的来源。透射电镜证明氧化铜被锂还原的机理包括固溶体Cu的形成II 1-x Cu Ix O 1-x/2(0<x<0.4),然后发生相变形成氧化亚铜,再形成铜分散在氧化锂网格中,认为氧化储锂过程主要是由于锂的可逆形成和分解-由于纳米铜或其他 3d 金属颗粒的高活性,氧键。对于Tarascon小组提出的锂-氧键的可逆断裂和形成机制,JRDahn原位X射线衍射和穆斯堡尔光谱研究表明,氧化物在过程中发生电化学置换反应,迅速分解形成锂氧化物和金属。放电过程,反应产物为纳米级金属。在充电过程中,金属首先被氧化,然后被氧化的金属取代氧化锂中的锂,形成金属氧化物和锂。比如在CoO中,这个反应在充电时不会改变氧化锂中的氧晶格,有点像离子交换反应。这种现象也存在于氧化铁中。在放电过程中,就好像锂离子取代了氧化物中的金属原子。在随后的循环中,这种交换反应可逆地进行。目前氧化物的嵌锂机理尚存争议,但这并不妨碍我们利用氧化物制备新的电极材料。JRDahn 等。研究了使用氧化锂或硫化锂和金属纳米粒子获得的复合材料的嵌锂行为。该材料表现出电化学活性,容量为600mA·h/g。
其他氧化物负极材料还有MO 2、MnO 2、TiO 2、VO 2、CrO 2 、 NbO 2、MoO 2 、 WO 2、RuO 2、OsO 2、IrO 2、α-MoO 3等具有金红石结构的材料.

负极材料
4.其他负极材料
过渡金属氮化物是另一类受到广泛关注的负极材料。TakeshiA.sai 等人。1984年报道了Cu x Li 1-x N的制备和离子电导性能,以及取代Li 3 N中部分阳离子得到的锂铜氮。由于铜与氮之间存在部分共价键,活化能为减少到 0.13 eV。此外,由于取代,锂空位减少,锂离子电导率降低。O.Yamamoto团队对Li 7 FeN 2 , Li 7 MnN的电化学嵌锂过程进行了深入研究4、Li 2.6 M 0.4 N (M=Co, Ni, Cu)材料,发现这些材料具有高达900mA·h/g的容量,并且具有良好的循环性。其他团队也在氮化物方面做了大量工作。由于含锂负极不适用于目前的锂离子电池体系,制备成本、对空气的敏感性等因素距离实际应用还很远,但它提供了另一种电极材料的选择。与其他电极材料结合补偿首次不可逆容量损失也是一个很好的尝试。
其他如硼酸盐、氟化物、硫化物等,也有用于锂离子电池负极材料研究的报道。阿拉扎克等人。研究了具有富勒烯结构的金属硫化物(WS 2 , MoS 2 )纳米粒子的碱金属插层情况。表面的密封层是嵌锂的主要限制因素。

其他负极材料
5、复合负极材料
目前商用锂离子电池所用的负极材料都是碳材料,包括石墨化中间相碳微珠(MCMB)等石墨化碳材料和一些热解硬碳。目前,这些碳材料的实际比容量一般不超过400mA·h/g。虽然高于目前大部分正极材料的比容量(通常为120~180mA·h/g),但由于碳材料的致密性、密度低,一般负极集电体采用重铜箔和正极采用较轻的铝箔,因此正极材料的实际体积高于负极;因此,电池的比能量应该进一步提高,而负极材料的嵌锂性能是研发的关键。而且,随着电子产品的日益普及,对高比能量电池的需求也越来越高。目前,没有任何一种材料能够完全满足相关需求。碳材料虽然循环性能好,但比容量低;具有高比容量的碳材料的其他电化学性能受到损害。该合金材料具有较高的比能,但由于嵌锂过程中体积膨胀较大,材料的循环性能远不能满足要求。锡基复合氧化物具有良好的循环特性,但未能解决首次不可逆容量损失问题。从这个角度来看,结合各种材料的优点,有目的地组合各种材料,避免各自的缺点,才是合理的选择。复合负极材料的形成是一个合理的选择。目前对复合材料的研究已经取得了一定的成果。
对于材料的首次不可逆容量损失,有人提出采用含锂的过渡金属氮化物进行补偿,利用锂和氧化锡反应解决氧化锡材料的首次不可逆容量损失。
针对合金材料循环性能差的问题,有人提出了将一种活性物质分散在另一种非活性物质中形成复合材料的想法。这些努力包括使用 Thackeray 等人提出的由过量铜形成的惰性网格。改善铜锡合金的电化学循环。Hisashi Tamai 等人。使用有机锡制备复合材料,纳米级锡分散在碳网格中,以提高材料的可回收性。例如,石墨-锡复合材料是通过球磨制备的;研究了由导电聚合物/金属合金组成的复合材料;通过CVD法将碳包覆在硅颗粒表面,发现表面包覆后硅的电化学循环有很大的改善,反复循环后硅粒不破裂;制备了导电聚合物和锂合金复合电极。这些都在一定程度上显着改善和增强了合金材料的电化学循环性能。