

将锰源、锂源(LiOH·H 2 O)和矿化剂按一定比例密封在高压反应釜中,通过外加热控制合成反应温度不高于220℃,合成正交层状锂氧化锰。
溶剂热法制备的纳米粒子通常具有物相均匀、纯度高、晶型好、单分散、形貌尺寸可控等特点。在溶剂热处理过程中,温度、压力、处理时间、所用前驱体的种类和体系的pH值对粉体的粒径和形貌,以及反应速率和结晶度都有很大的影响产品的形式。使用γ-MnOOH、Mn 2 O 3、Mn 3 O 4和MnO 2 作为原料,o-LiMnO2可以通过水热反应过程有效合成。使用溶剂热法对低温高压条件的考虑使得Li+能够有效地迁移到锰化合物中形成锂锰。氧化合物。
现以溶剂热法合成锂锰氧化物为例。Mn 3 O 4-δ的合成:将一定量的MnO 2 粉末和无水乙醇放入密封的反应釜中,在一定温度下加热12小时,随炉自然冷却至室温即可。得到红棕色产品。
Li x MnO 2的合成:取一定量的MnO 2 粉末、LiOH·H 2 O和NaOH置于100mL衬有聚四氟乙烯的不锈钢反应釜中,加入溶剂无水乙醇至容器体积的75%。反应釜在一定温度下密闭加热12小时后,随炉自然冷却至室温。收集灰褐色沉淀物,用无水乙醇洗涤,产物在80℃真空干燥箱中干燥24小时。
高纯四方Mn 3 O 4-δ 纳米晶适用于制作高频转换器、磁头、锰锌铁氧体磁芯等软磁材料。Mn 3 O 4-δ 也适用于制备锂离子电池正极材料尖晶石锂锰氧固溶体的原料。非化学计量的Mn 3 O 4-δ由八面体Mn 3 O 4-δ相和四面体MnO 相组成。结构中的氧空位是其催化活性中心。由于Mn 3 O 4-δ 是制备锂锰氧化物电极材料的中间体化合物,阐明制备过程中各种锰氧化物的存在形式、成键方式和反应机理,研究制备高纯Mn 3 的相变过程和反应O 4 历史和晶粒生长动力学是非常必要的。Mn 3 O 4的制备方法按原理 可分为低价锰的氧化法和高价锰的还原法两种。一般将各种锰的氧化物、氢氧化物、硝酸盐、碳酸盐和硫酸盐在1000℃高温下煅烧可得到Mn 3 O 4, 而煅烧法只能得到大颗粒的Mn 3 O 4 。 液相法或水热法可合成粒径均匀、形貌可控的Mn 3 O 4 。
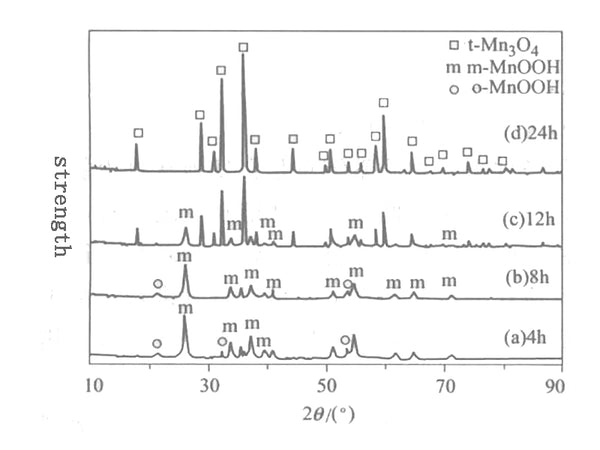
图1 Mn O 2 与乙醇反应产物的XRD图谱
图1为0.2mol MnO 2 与乙醇在160℃反应不同时间后得到的产物的XRD图谱。图1表明MnO 2 在160℃反应4小时后可完全转化为单斜晶系和斜方晶系的MnOOH;反应8小时后,产物以单斜MnOOH相为主,仍有少量正交MnOOH存在;在160℃反应12h后,正交的o-MnOOH相消失,单斜m-MnOOH相的数量也明显减少。产生的新相是四方相t-Mn 3 O 4;反应24h后,m-MnOOH相全部消失,四方相t-Mn 3 O 4 得到纯相和完整的晶形。从以上分析可以看出,160℃的合成反应时间对溶剂热产物的物相影响很大。在此条件下,溶剂热合成反应时间延长,相变为:MnO 2 →m-MnOOH+o-MnOOH→m-MnOOH+t-Mn 3 O 4 →t-Mn 3 O 4。了解Mn 3 O 4溶剂热合成的这一相变过程。利用溶剂热合成锂锰氧化物电工材料具有实用的指导作用。
从实验现象看,在160℃溶剂热反应4h后,固相颜色由黑色MnO 2 变为棕色MnOOH;溶剂热反应24h后,固相颜色由黑色MnO 2 变为红棕色Mn 3 O 4 ,其XRD衍射峰与t-Mn 3 O 4的JCPDS卡(24-0734)完全对应,有无杂质峰。
当合成反应时间较短时,弱还原剂C 2 H 5 OH被氧化为CH 3 CHO,MnO 2 被还原为MnOOH。化学反应式如下:
2MnO 2 +C 2 H 5 OH→2MnOOH+CH 3 CHO
当合成反应时间较长时,MnOOH脱水或继续与乙醇反应生成Mn 2 O 3 或Mn 3 O 4。可能的化学反应式为:
2MnOOH→Mn 2 O 3 +H 2 O
6MnOOH→Mn 3 O 4 +3H 2 O+(1/2)O 2
或:
2MnOOH+C 2 H 5 OH→Mn 2 O 3 +CH 3 CHO+H 2 O
6MnOOH+C 2 H 5 OH→2Mn 3 O 4+CH 3 CHO+4H 2 O
因此,一般化学反应式为:
6MnO 2 +3C 2 H 5 OH→2Mn 3 O 4 +3CH 3 CHO+(1/2)O 2 +3H 2 O
2MnO 2 +C 2 H 5 OH→Mn 2 O 3 +CH 3 CHO+H 2 O
或:
3MnO 2 +2C 2 H 5 OH→Mn 3 O 4 +2CH 3 CHO+2H 2 O
2MnO 2 +2C 2H 5 OH→Mn 2 O 3 +2CH 3 CHO+H 2 O
从热力学第二定律我们知道,在等温和压力条件下,物质体系总是自发地从自由能较高的状态向自由能较低的状态转变。也就是说,只有自由能降低的过程才能自发进行,或者只有当新相的自由能低于旧相的自由能时,旧相才能自发地转变为新相。上述反应经热力学计算均小于零,即这四个反应在一定条件下均能自发进行。由于Mn 3 O 4比Mn 2 O 3 更稳定存在,最终的无机产物为Mn 3 O4 纳米晶。该热力学分析结果与XRD表征结果一致。
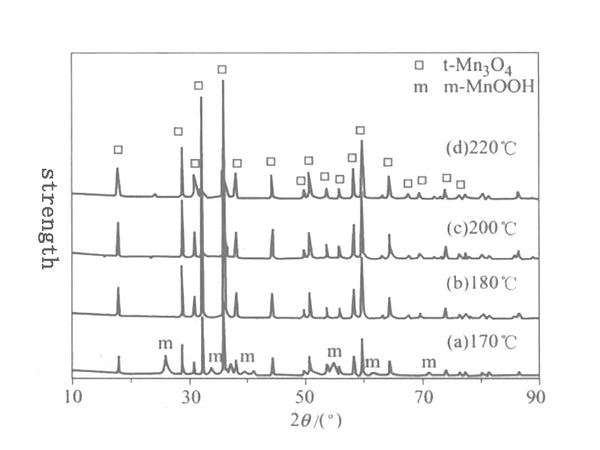
图2不同温度下溶剂热反应24h Mn 3 O 4样品的XRD谱
图 2 显示了溶剂热反应在不同温度下 24 小时的 XRD 图谱。在180~220℃溶剂热反应24h后,产物晶型均为四方Mn 3 O 4。用最小二乘法根据下式计算四方晶系Mn 2 O 3 的晶胞参数,由XRD衍射仪的自载度和XRD的XRD半宽度计算晶粒尺寸(D) . 合成产物在180~220℃温度下的结构参数见表1,其中c/a=1.63,表明合成的Mn3O4晶体具有四方对称性。
1/(dhkl²)=[(h²+k²)/a²]+(l²/c²)
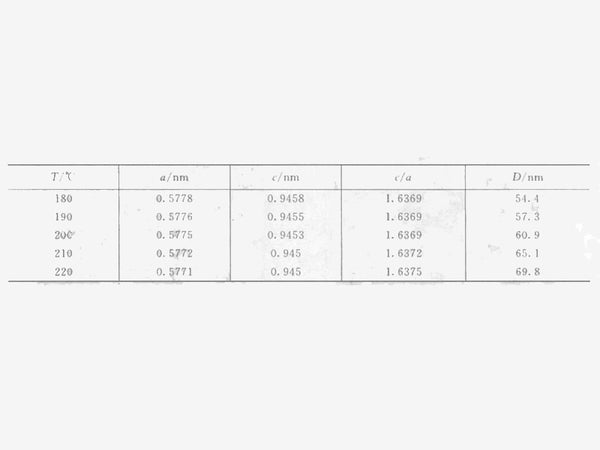
表1不同温度下溶剂热还原法制备的Mn 3 O 4的晶胞参数和晶粒尺寸
180℃和200℃溶剂热条件下生成的Mn 3 O 4粒子的SEM照片表明,两种样品的形貌均为四方三维形状,Mn 3 O 4粒子呈团聚状态。SEM 显示的粒径高于 XRD 数据计算的晶粒尺寸。在 180°C 下合成的样品的粒径大约大十倍,其粒径明显小于在 200°C 下合成的样品的粒径。
在密闭条件下,液体的平衡蒸气压由温度决定,一般与液体的量和容器的大小无关。根据汽化热与沸点的关系:
LnP=[﹣(△ vap·T H m )/RT]+C
可得沸点与饱和蒸气压的对应关系。式中,P为饱和蒸气压;T为热力学温度;R是气体常数;C是常数;Δvap.T H m为在一定温度下的汽化热。
由上式可知,液体的蒸气压一般具有随温度急剧上升的特性。由于加入的乙醇大量过量,反应器中乙醇的分压随着反应温度的升高而升高。可以推测,随着反应温度的升高,晶粒的生长速度会加快。从表1可以看出,根据XRD半宽计算的晶粒尺寸从180℃时的54.4nm增加到220℃时的69.8nm。
在对t-Mn 3 O 4溶剂热合成的研究中发现,随着溶剂热合成温度的升高和反应时间的延长,相变发生如下:MnO 2 →m-MnOOH +o -MnOOH→m-MnOOH+t-Mn 3 O 4 →t-Mn 3 O 4,其中o-MnOOH不稳定,先反应,所以加入LiOH可得到正交层状的锰酸锂。
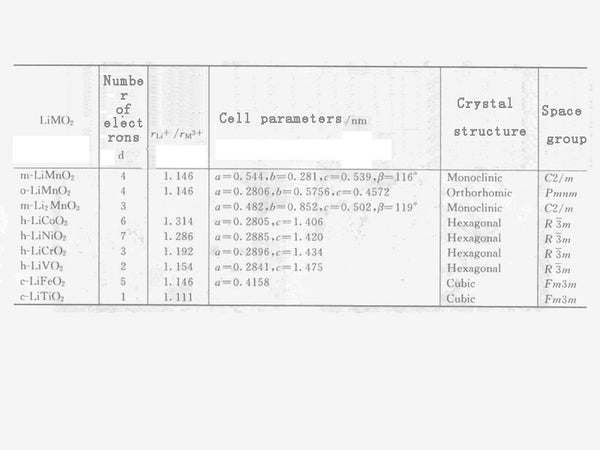
表2 LiM O 2 阳离子半径比与晶胞参数、晶体结构、空间群的关系。
层状锰酸锂与其他LiMO 2 固溶体的阳离子半径比与晶体结构和晶胞参数的关系如表2所示。从表2可以看出,根据阳离子半径比,LiMnO 2 岩盐大致可分为单斜晶系、正交晶系和六方晶系三种,晶体对称性不同。若r Li + /r M 3+较大,则可得到六方晶系的 层状岩盐稳定相LiCoO 2、LiNiO 2 和LiCrO 2 。

图4水热法制备的LiCoP O 4的SEM图(反应条件:220℃5小时,pH=8.50)

图5水热法制备的LiMn 2 O 4的SEM图
图3和图4分别是通过水热法制备的LiCoPO 4 和LiMn 2 O 4 的SEM图像。